1.3 PROCESO, ESTADO Y FASES TERMODINÁMICAS
Proceso
termodinámico: Es a la evolución de determinadas magnitudes (o propiedades)
propiamente termodinámicas relativas a un determinado sistema termodinámico.
Desde el punto de vista de la termodinámica, estas transformaciones deben
transcurrir desde un estado de equilibrio inicial a otro final.
Ejemplos:
·
Proceso
cuasiestático: Todos los estados intermedios del proceso son estados de
equilibrio. Este proceso realmente no existe, es ideal o teórico. Puede
aproximarse tanto más cuanto la causa del proceso varía en cantidades cada vez
más pequeñas.
·
Proceso
no estático: Cuando no cumple las condiciones anteriores. Son los procesos
de igualación.
·
Proceso
reversible: Es un proceso cuasiestático, que puede ser llevado de nuevo al
estado inicial pasando por los mismos estados intermedios que el proceso directo,
y sin que al final, ni en el sistema ni en el medio rodeante, quede ningún
efecto residual que pueda revelar que se ha verificado el proceso.
·
Proceso
irreversible: Son los procesos reales. En ellos siempre habrá degradación
de energía y generación de entropía.
·
Proceso
adiabático: Un proceso es adiabático cuando no se produce intercambio de
calor entre el sistema y el ambiente. Esta situación se tendría cuando hubiera
un aislamiento térmico perfecto del sistema, o cuando el proceso ocurriera tan
rápido que no hubiera prácticamente transferencia de calor.
·
Proceso
es isotérmico: Son los procesos cuyas magnitudes permanecen “constantes”,
es decir que el sistema cambia manteniendo cierta proporcionalidad en su
transformación.
·
Proceso
isobárico: Procesos en los cuales antes durante y despues la presion es
constante.
·
Proceso
Isométrico o isocorico: El volumen es constante antes durante y después.
Estado
termodinámico: es un conjunto de los valores que toman las propiedades de
un sistema termodinámico que deben ser especificadas para reproducir el
sistema. Los parámetros individuales son conocidos como variables de estado,
parámetros de estado o variables termodinámicas. Si a su vez estos valores no
cambian con el tiempo, el sistema se dice que está en equilibrio termodinámico,
para el cual no existe un flujo de masa o energía. El equilibrio termodinámico
se establece una vez que el sistema alcanza otro tipo de equilibrios.
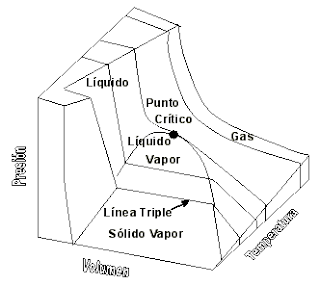
Fase termodinámica:
En termodinámica y química, se denomina fase a cada una de las zonas
macroscópicas del espacio de una composición química, y sus propiedades físicas
homogéneas, que forman un sistema. Los sistemas monofásicos se denominan
homogéneos, y los que están formados por varias fases se denominan mezclas o
sistemas heterogéneos.
SISTEMAS
Un sistema termodinámico (también
denominado sustancia de trabajo) se define como la parte del universo objeto de
estudio. Es aquella región de espacio físico cuyas propiedades se investigan.
·
Sistema
aislado: es aquél que no intercambia ni materia ni energía con los
alrededores.
·
Sistema
cerrado: es aquél que intercambia energía (calor y trabajo) pero no materia
con los alrededores (su masa permanece constante).
·
Sistema
abierto: es aquél que intercambia energía y materia con los alrededores.

Comentarios
Publicar un comentario