3. LEY DE CONSERVACIÓN DE MASA
El primer principio de la termodinámica o primera ley de la
termodinámica1 es un principio que refleja la conservación de la energía en el
contexto de la termodinámica.
El trabajo de la conexión adiabática entre dos estados de
equilibrio de un sistema cerrado depende exclusivamente de ambos estados
conectados.
Este enunciado supone formalmente definido el concepto de
trabajo termodinámico, y sabido que los sistemas termodinámicos sólo pueden
interaccionar de tres formas diferentes (interacción másica, interacción
mecánica e interacción térmica). En general, el trabajo es una magnitud física
que no es una variable de estado del sistema, dado que depende del proceso
seguido por dicho sistema. Este hecho experimental, por el contrario, muestra
que para los sistemas cerrados adiabáticos, el trabajo no va a depender del
proceso, sino tan solo de los estados inicial y final. En consecuencia, podrá
ser identificado con la variación de una nueva variable de estado de dichos
sistemas, definida como energía interna.
3.1.1 FLUIDO
INCOMPRESIBLE
En mecánica de fluidos, un flujo se clasifica en compresible
e incompresible, dependiendo del nivel de variación de la densidad del fluido
durante ese flujo. La incompresibilidad es una aproximación y se dice que el
flujo es incompresible si la densidad permanece aproximadamente constante a lo
largo de todo el flujo. Por lo tanto, el volumen de todas las porciones del
fluido permanece inalterado sobre el curso de su movimiento cuando el flujo o
el fluido es incompresible. En esencia, las densidades de los líquidos son
constantes y así el de ellos es típicamente incompresible.
Cuando se analizan flujos de gas a velocidades altas, la
velocidad del flujo a menudo se expresa en términos del número adimensional de
Mach, que se define como
3.1.2 FLUIDOS
COMPRESIBLE
Todos los fluidos son compresibles excepto el agua,
incluyendo los líquidos. Cuando estos cambios de volumen son demasiado grandes
se opta por considerar el flujo como compresible (que muestran una variación
significativa de la densidad como resultado de fluir), esto sucede cuando la
velocidad del flujo es cercano a la velocidad del sonido. Estos cambios suelen
suceder principalmente en los gases ya que para alcanzar estas velocidades de
flujo en líquidos, se precisa de presiones del orden de 1000 atmósferas, en
cambio un gas sólo precisa una relación de presiones de 2:1 para alcanzar
velocidades sónicas.
La compresibilidad de un flujo es básicamente una medida en
el cambio de la densidad. Los gases son en general muy compresibles, en cambio,
la mayoría de los líquidos tienen una compresibilidad muy baja. Por ejemplo,
una presión de 500 kPa provoca un cambio de densidad en el agua de solamente
0,024% (a temperatura ambiente). En cambio, esta misma presión aplicada al aire
provoca un cambio de densidad de 250%. Por esto normalmente al estudio de los
flujos compresibles se le conoce como dinámica de gases, siendo esta una nueva
rama de la mecánica de fluidos, la cual describe estos flujos.
Los flujos compresibles pueden ser clasificados de varias
maneras, la más común usa el número de Mach (M) como parámetro para
clasificarlo.
3.2 LEY DE
CONSERVACIÓN DE MOMENTO
El momento de un sistema aislado es una constante. La suma
de vectores de momentos mv de todos los objetos de un sistema, no pueden ser
cambiados por interacciones dentro del propio sistema. Esto supone una fuerte
restricción a los tipos de movimientos que pueden ocurrir en un sistema
aislado. Si a una parte del sistema se le da un determinado momento en una
dirección determinada, entonces alguna otra parte del sistema obtendrá
simultáneamente, exactamente el mismo momento en dirección opuesta. Hasta donde
podemos decir la conservación del momento es una simetría absoluta de la
naturaleza. O sea, no conocemos nada en la naturaleza que lo viole.
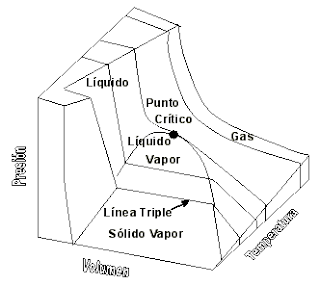
3.4 ECUACIÓN DE
ESTADO
Las ecuaciones de estado son útiles para describir las
propiedades de los fluidos, mezclas, sólidos o incluso del interior de las
estrellas. Cada sustancia o sistema hidrostático tiene una ecuación de estado
característica dependiente de los niveles de energía moleculares y sus energías
relativas, tal como se deduce de la mecánica estadística.
El uso más importante de una ecuación de estado es para
predecir el estado de gases. Una de las ecuaciones de estado más simples para
este propósito es la ecuación de estado del gas ideal, que es aproximable al
comportamiento de los gases a bajas presiones y temperaturas mayores a la
temperatura crítica. Sin embargo, esta ecuación pierde mucha exactitud a altas
presiones y bajas temperaturas, y no es capaz de predecir la condensación de
gas en líquido. Por ello, existe una serie de ecuaciones de estado más precisas
para gases y líquidos. Entre las ecuaciones de estado más empleadas sobresalen
las ecuaciones cúbicas de estado. De ellas, las más conocidas y utilizadas son
la ecuación de Peng-Robinson (PR) y la ecuación de Redlich-Kwong-Soave (RKS).
Hasta ahora no se ha encontrado alguna ecuación de estado que prediga
correctamente el comportamiento de todas las sustancias en todas las
condiciones.
se puede usar cualquier sistema de unidades aunque se
prefieren las unidades del Sistema Internacional de Unidades:
P = Presión (atmósferas)
V = Volumen
n = Número de moles
ν = V/n = Volumen molar, el volumen de un mol de gas
T = Temperatura (K)
R = constante de los gases ideales (8,314472 J/mol·K) o
(0,0821 atm·L/gmol·K)





Comentarios
Publicar un comentario